|
|
Τα αλκάνια (Alkane) ή κορεσμένοι υδρογονάνθρακες ή παραφίνες θεωρούνται οι πιο απλές οργανικές ενώσεις. Ο χημικός τύπος των ενώσεων της ομόλογης σειράς των κορεσμένων υδρογονανθράκων ανάλογα με τον αριθμό των ατόμων άνθρακα (n) που περιέχουν δίνεται από τον γενικό συντακτικό τύπο CnH2n+2. Έτσι το απλούστερος δυνατό μέλος της σειράς είναι το μεθάνιο (CH4) και το αμέσως επόμενο το αιθάνιο (C2H6).
Όλα τα άτομα άνθρακα που αποτελούν τα αλκάνια είναι συνδεδεμένα μεταξύ τους με απλούς δεσμούς και θεωρούνται κεκορεσμένα με την έννοια ότι υπάρχουν αρκετά άτομα υδρογόνου για να καλύψουν τις ανάγκες των ηλεκτρονίων των ατόμων του άνθρακα. Οι ενώσεις αυτές ονομάζονται παραφίνες λόγω των πολύ συνεκτικών και σταθερών δεσμών τους και την συνακόλουθη μικρή χημική δραστικότητά τους.
* Αν από μόριο αλκανίου αφαιρεθεί ένα άτομο υδρογόνου προκύπτει η ρίζα του αλκυλίου με γενικό τύπο CnH2n+1 ή συνοπτικά: R-
* Οι κορεσμένοι υδρογονάνθρακες στους οποίους τα άτομα άνθρακα σχηματίζουν δακτύλιο ονομάζονται κυκλοαλκάνια και έχουν γενικό τύπο CnH2n.
Ισομέρεια
Τα αλκάνια στα οποία τα άτομα άνθρακα είναι ενωμένα μεταξύ τους έτσι ώστε να δίνουν μία ευθεία αλυσίδα, ονομάζονται κανονικά αλκάνια. Εκτός από τα αλκάνια ευθείας αλυσίδας, υπάρχουν και αλκάνια διακλαδισμένης αλυσίδας. Σε αυτά τα μόρια, ένα ή περισσότερα από τα υδρογόνα έχουν αντικατασταθεί από αλκύλια (CH2 ή CH3) και έχουν προκύψει οι λεγόμενες ισομερείς ενώσεις. Παρόλο που ο συντακτικός τύπος παραμένει ο ίδιος, η δομή παρουσιάζεται πιο συμπαγής λόγω των διακλαδώσεων.
Κάθε αλκάνιο έχει ένα ορισμένο αριθμό ισομερών ανάλογα με των αριθμό ατόμων άνθρακα που περιέχει. Τα πρώτα τρία μέλη της ομόλογης σειράς (μεθάνιο, αιθάνιο, προπάνιο) δεν διαθέτουν ισομερή, ενώ το βουτάνιο έχει δύο και το πεντάνιο τρία ισομερή, το δωδεκάνιο 355 και το τεσσαρακοντάνιο (C40H82) φθάνει να έχει 6,2*1013 πιθανά ισομερή. Επειδή τα ισομερή αυτά έχουν διαφορετικές δομές έχουν και διαφορετικές ιδιότητες όπως φαίνεται στον πίνακα με τα ισομερή του πεντανίου.
| Τύπος | Όνομα | Μοριακό Βάρος |
Σημείο ζέσεως (°C, 1 bar) |
Κρίσιμη πίεση (psia) |
Κρίσιμη Θερμοκρασία (°C) |
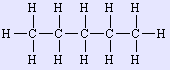 |
n-πεντάνιο | 72,149 | 36,06 | 488,6 | 196,50 |
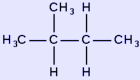 |
ισοπεντάνιο | 72,149 | 27,84 | 490,4 | 187,24 |
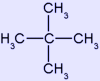 |
νεοπεντάνιο | 72,149 | 9,50 | 464,0 | 160,60 |
Ονοματολογία
Τα πρώτα τέσσερα μέλη της σειράς των αλκανίων, με χωρίς διακλαδώσεις ανθρακική αλυσίδα, ονομάζονται αντίστοιχα μεθάνιο, αιθάνιο, προπάνιο και βουτάνιο. Τα υπόλοιπα μέλη ονομάζονται από τον αριθμό των ατόμων άνθρακα που περιέχουν και την κατάληξη “-άνιο”. Έτσι, έχουμε για παράδειγμα τις παρακάτω ενώσεις ανάλογα με το αριθμό ατόμων άνθρακα, n.
| n | n | n | |||
| 1 | Μεθάνιο | 4 | Βουτάνιο | 19 | Δεκαεννεάνιο |
| 2 | Αιθάνιο | 5 | Πεντάνιο | 30 | Τριακοντάνιο |
| 3 | Προπάνιο | 10 | Δεκάνιο | 70 | Εβδομηκοντάνιο |
Οι μονοσθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ενός ατόμου υδρογόνου από ακραίο άτομο άνθρακα, ονομάζονται όπως τα αντίστοιχα αλκάνια με αντικατάσταση της καταλήξεως “-άνιο” από την κατάληξη “-ύλιο”. Η αρίθμηση της ανθρακικής αλυσίδας αρχίζει από τον άνθρακα με το ελεύθερο σθένος.
π.χ. Μεθύλιο: CH3- , Αιθύλιο: CH3CH2-, Πεντύλιο: CH3CH2CH2CH2CH2-
Οι δισθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ατόμων υδρογόνου από δύο ακραία άτομα άνθρακα, ονομάζονται αιθύλενο-, τριμεθύλενο-, τετραμεθύλενο-, κ.ο.κ., ανάλογα με τον αριθμό ατόμων άνθρακα.
π.χ. Αιθύλενο-: -CH2CH2- , Τριμεθύλενο: -CH2CH2CH2-
Οι επόμενοι κανόνες κατά IUPAC εφαρμόζονται για την απόδοση ονομάτων σε αλκάνια διακλαδισμένης αλυσίδας:
1. Προσδιορίζεται η μακρύτερη συνεχόμενη (όχι υποχρεωτικά ευθεία) αλυσίδα ατόμων άνθρακα στο μόριο. Το βασικό όνομα του αλκανίου διακλαδισμένης αλυσίδας είναι το όνομα του αλκανίου ευθύγραμμης αλυσίδας, το οποίο αντιστοιχεί στον αριθμό ατόμων άνθρακα αυτής της μακρύτερης αλυσίδας. Το πλήρες όνομα του αλκανίου περιλαμβάνει και το όνομα κάθε διακλαδισμένης αλυσίδας. Τα ονόματα αυτά τοποθετούνται μπροστά από το βασικό όνομα, όπως περιγράφουν οι επόμενοι κανόνες.
2. Κάθε αλυσίδα που εμφανίζεται ως διακλάδωση της μακρύτερης αλυσίδας παίρνει το όνομα μια αλκυλομάδας, δηλαδή της μονοσθενής ρίζας του αντίστοιχου αλκανίου η οποία ονοματίζεται όπως περιγράφεται παραπάνω.
3. Το πλήρες όνομα της διακλάδωσης απαιτεί ένα αριθμό ο οποίος εντοπίζει τη διακλάδωση πάνω στη μακρύτερη αλυσίδα. Για το σκοπό αυτό, αριθμείται κάθε άτομο άνθρακα της μακρύτερης αλυσίδας προς την κατεύθυνση που δίνει τους μικρότερους αριθμούς εντοπισμού όλων των διακλαδώσεων.
4. Όταν υπάρχουν περισσότερες από μία διακλαδώσεις αλκυλίων του ίδιο είδους, ο αριθμός τους υποδηλώνεται από ένα πρόθεμα, όπως δι-, τρι- ή τετρα-, το οποίο συνοδεύει το όνομα της διακλάδωσης. Η θέση κάθε ομάδας πάνω στη μακρύτερη αλυσίδα δίνεται από αριθμούς. Οι αριθμοί που υποδηλώνουν τη θέση διαχωρίζονται με κόμμα και ακολουθούνται από μία παύλα. Όταν υπάρχουν δύο ή περισσότερες διαφορετικές διακλαδώσεις αλκυλίων, το όνομα κάθε διακλάδωσης, μαζί με τον αριθμό θέσης προηγείται του βασικού ονόματος. Τα ονόματα των αλυσίδων τοποθετούνται είτε με αλφαβητική σειρά είτε με βάση την απλότητα των πλευρικών αλυσίδων.
Παράδειγμα
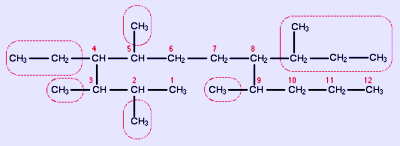
4-αιθυλο-2,3,5,9-τετραμεθυλο-8-sec-βουτυλο-δωδεκάνιο
Τέλος, οι παρακάτω υδρογονάνθρακες έχουν ιδιαίτερα ονόματα ανεξάρτητα από τους κανόνες ονοματολογίας:
| Ισοβουτάνιο | Ισοπεντάνιο | Ισοεξάνιο | Νεοπεντάνιο |
 |
 |
|
 |
Προέλευση
Τα αλκάνια απαντώνται τόσο στη Γη όσο και στο ηλιακό μας σύστημα, αλλά συνήθως μόνο τα περίπου εκατό πρώτα μέλη της ομόλογης σειράς και κυρίως σε ίχνη. Οι ελαφροί υδρογονάνθρακες, και κυρίως το μεθάνιο και το αιθάνιο, έχουν εντοπιστεί σε ουρές κομητών αλλά και σε μετεωρίτες. Επίσης, αποτελούν ένα σημαντικό ποσοστό της ατμόσφαιρας των αέριων πλανητών Δία, Κρόνου, Ουρανού και Ποσειδώνα. Στον Τιτάνα, δορυφόρο του Κρόνου, πιστεύεται ότι κάποτε υπήρχαν μεγάλοι ωκεανοί μικρών ή και μακρύτερων αλκανίων ενώ τώρα πιστεύεται ότι υπάρχουν μικρότερες θάλασσες υγρού αιθανίου.
Στη Γη οι κύριες πηγές των υδρογονανθράκων είναι τα ορυκτά καύσιμα (φυσικό αέριο, πετρέλαιο και γαιάνθρακες). Το φυσικό αέριο είναι κατά βάση μεθάνιο με μικρότερες ποσότητες άλλων αέριων αλκανίων (αιθάνιο, προπάνιο, βουτάνιο). Το πετρέλαιο είναι μείγμα αλκανίων και κυκλοαλκανίων με μικρότερες ποσότητες αρωματικών υδρογονανθράκων. Η δημιουργία των ορυκτών αυτών σχετίζεται με την δημιουργία ιζηματογενών πετρωμάτων και αποτελεί προϊόν αποδόμησης των ζωικών και φυτικών ιστών οι οποίοι παγιδεύτηκαν μέσα στα πετρώματα στη διάρκεια της δημιουργίας τους. Η διεργασία αυτή έλαβε χώρα στη διάρκεια εκατομμυρίων ετών. Αρχικά μία ποσότητα του οργανικού υλικού υπό την επίδραση αερόβιων μικροοργανισμών μετατράπηκε σε αέριο το οποίο και απελευθερώθηκε, ενώ απομακρύνθηκε το υδατοδιαλυτό μέρος του υλικού. Το υπόλειμμα δεν αποδομήθηκε λόγω έλλειψης οξυγόνου. Υπό την επίδραση αναερόβιων μικροοργανισμών τα μεγάλα οργανικά μόρια διασπάστηκαν δίδοντας συστατικά πλούσια σε άνθρακα και υδρογόνο. Η αυξημένη πίεση από το βάρος των υπερκειμένων στρωμάτων του πετρώματος και η υψηλή θερμοκρασία ολοκληρώνουν την μετατροπή της οργανικής ύλης σε πετρέλαιο. Τα αρχαιότερα κοιτάσματα χρονολογούνται στα 600 εκατομμύρια χρόνια και τα νεότερα σε 1 εκατομμύριο χρόνια.
Μοριακή Γεωμετρία
Το άτομο του άνθρακα στη θεμελιώδη του κατάσταση εμφανίζει μία ηλεκτρονική διαμόρφωση με τρία 2p τροχιακά και ένα 2s τροχιακό. Με βάση την ηλεκτρονική θεωρία του σθένους, κατά την οποία το αριθμητικό σθένος εξισώνεται με τον αριθμό των μονήρων ηλεκτρονίων σθένους, το άτομο του άνθρακα θα έπρεπε να εμφανίζεται ως δισθενές και όχι τετρασθενές. Για να εξηγήσει λοιπόν την τετρασθένειά του και την ισοτιμία των τεσσάρων σθενών, ο Αμερικανός χημικός Linus Pauling διατύπωσε τη θεωρία του υβριδισμού των ατομικών τροχιακών.
Σύμφωνα με τη θεωρία αυτή, η εξίσωση του αριθμητικού σθένους με τον αριθμό των μονήρων ηλεκτρονίων εξηγείται με την παραδοχή ότι ένα ηλεκτρόνιο από την 2s τροχιά ανυψώνεται στην κενή 2pz τροχιά. Τα τέσσερα τροχιακά που δημιουργούνται μ' αυτόν τον τρόπο υβριδοποιούνται, οπότε δημιουργούνται τέσσερα ισότιμα υβριδοποιημένα τροχιακά που συμβολίζονται ως sp3. Οι δεσμοί που δημιουργούνται είναι ισότιμοι, ονομάζονται σ δεσμοί και έχουν τετραεδρική διάταξη με γωνία μεταξύ των δεσμών 109,3°.
Παραγωγή
Βιομηχανικό ενδιαφέρον συνθετικής παρασκευής αλκανίων δεν υπάρχει, διότι όλες οι ανάγκες καλύπτονται από φυσικές πηγές. Η γνώση όμως των μεθόδων συνθετικής παρασκευής αλκανίων παρουσιάζει ενδιαφέρον για την Συνθετική Οργανική Χημεία. Έτσι, οι σπουδαιότεροι τρόποι δημιουργίας των δεσμών C-H και C-C, που απαρτίζουν τα μόρια των αλκανίων είναι οι ακόλουθοι:
* Καταλυτική αναγωγή αλκενίων και αλκινίων. Η υδρογόνωση ακόρεστων υδρογονανθράκων οδηγεί σε αλκάνια, των οποίων οι αποδόσεις προσεγγίζουν το 100%, συνήθως παρουσία καταλυτών όπως πλατίνα και παλλάδιο.
R-CH=CH2 + H2 → RCH2CH3
C6H6-C≡CH + 2H2 → C6H6-CH2CH3
Ο αρωματικός δακτύλιος δεν υφίσταται αναγωγή με την επίδραση συνηθισμένων συνθηκών αναγωγής (θερμοκρασία 30°C, πίεση υδρογόνου 1 bar), μπορεί όμως να αναχθεί με την επίδραση δραστικότερων συνθηκών και τη χρησιμοποίηση πολύ ενεργών καταλυτών. Τέλος πρέπει να σημειωθεί ότι η υδρογόνωση των ακόρεστων ενώσεων χρησιμοποιείται για τον ποσοτικό προσδιορισμό της ακορεστότητας.
* Αναγωγή αλκυλαλογονιδίων (RX). Σ' αυτή τη μέθοδο χρησιμοποιούνται διάφορα αναγωγικά μέσα, η εκλογή του οποίου εξαρτάται κυρίως από τη φύση του αλκυλαλογονιδίου (πρωτοταγές, δευτεροταγές ή τριτοταγές).
RX + 2[H] → RH + HX
RX + HX → RH + X2
4RX + LiAlH4 → 4RH + LiX + AlX3
όπου Χ συμβολίζει ένα αλογόνο και R ένα αλκύλιο.
* Μέθοδος Wurtz. Κατά την επίδραση νατρίου σε αλκυλοβρωμίδια ή αλκυλοϊωδίδια (RI) σχηματίζονται αλκάνια. Μειονέκτημα της μεθόδου αποτελεί ο σχηματισμός μίγματος αλκανίων σε περίπτωση που έχουμε δύο διαφορετικά αλκυλαλογονίδια.
RI + 2Na → R-Na+ + NaI
RI + R-Na+ → R-R + NaI
* Ηλεκτρολυτική μέθοδος Kolbe. Κατά την ηλεκτρόλυση διαλυμάτων αλάτων λιπαρών οξέων με αλκάλια σχηματίζονται στην άνοδο αλκάνια. Για την αντίδραση Kolbe έχουν προταθεί διάφοροι μηχανισμοί, με επικρατέστερο των μηχανισμό ελεύθερων ριζών.
Εικόνα:Ηλεκτρολυτική Mέθοδος Kolbe.png
Το μειονέκτημα και αυτής της μεθόδου είναι ο σχηματισμός παραπροϊόντων.
* Υδρόλυση οργανομαγνησιακών ενώσεων. Υδρογονάνθρακες μπορούν να συντεθούν με κατεργασία της οργανομαγνησιακής ενώσεως με άλλη ένωση που περιέχει υδρογόνο με ασθενώς όξινο χαρακτήρα.
RMgX + HOH → RH + Mg(OH)X
* Αποκαρβοξυλίωση αλάτων λιπαρών οξέων. Κατά τη θέρμανση αλάτων λιπαρών οξέων με νατράσβεστο (μείγμα υδροξειδίου του νατρίου και οξειδίου του ασβεστίου) σχηματίζονται αλκάνια.
RCOONa + NaOH(CaO) → RH + Na2CO3
Φυσικές Ιδιότητες
Τα μέλη της ομόλογης σειράς των αλκανίων έχουν φυσικές ιδιότητες οι οποίες μεταβάλλονται κατά μήκος της σειράς με κανονικό τρόπο. Έτσι υπό κανονικές συνθήκες, τα πρώτα μέλη της σειράς από 1 έως 4 άτομα άνθρακα είναι αέρια, τα μέσα μέλη άνω του βουτανίου είναι υγρά και τα ανώτερα αλκάνια, άνω του δεκαπεντανίου, είναι στερεά. Σε γενικές γραμμές για κάθε μεθυλενική ομάδα που προστίθεται το σημείο ζέσεως αυξάνεται από 20 έως 30°C, όπως φαίνεται και στο διπλανό διάγραμμα. Από την άλλη, το σημείο τήξης των κανονικών αλκανίων, παρόλο που αυξάνεται επίσης με την αύξηση των ατόμων άνθρακα (με την εξαίρεση του προπανίου), αυξάνεται εμφανώς πιο αργά ιδιαίτερα στα ανώτερα αλκάνια. Επίσης, το σημείο τήξης των αλκανίων με περιττό αριθμό ατόμων άνθρακα αυξάνεται γρηγορότερα από το σημείο τήξης των αλκανίων με ζυγό αριθμό ατόμων άνθρακα.
Γενικά, τα γραμμικά αλκάνια έχουν υψηλότερο σημείο ζέσεως από τα αντίστοιχα διακλαδισμένα. Αυτό αποδίδεται στις δυνάμεις van der Waals που ασκούνται εντονότερα μεταξύ των μορίων γραμμικών αλκανίων από ότι μεταξύ των μορίων διακλαδισμένων αλκανίων. Στα διακλαδισμένα αλκάνια, τα οποία έχουν περισσότερο σφαιρικό σχήμα από τα γραμμικά και άρα μικρότερη εξωτερική επιφάνεια, η επαφή μεταξύ των μορίων είναι μικρότερη και επομένως μεταξύ των μορίων ασκούνται ασθενέστερες δυνάμεις van der Waals.
Τα αλκάνια θεωρούνται άπολες ενώσεις και γι' αυτό το λόγο δεν σχηματίζουν δεσμούς υδρογόνου και δεν διαλύονται σε πολικούς διαλύτες όπως το νερό και οι αλκοόλες. Αντίθετα, διαλύονται εύκολα σε άπολους διαλύτες όπως το βενζόλιο και ο τετραχλωράνθρακας. Τέλος, διάφορα αλκάνια μπορούν αναμιχθούν μεταξύ τους σε διάφορες αναλογίες.
Η πυκνότητα των αλκανίων αυξάνεται με την αύξηση του αριθμού των ατόμων άνθρακα αλλά παραμένει μικρότερη από αυτή του νερού. Έτσι, σε ένα μείγμα νερού-αλκανίων τα αλκάνια διατηρούνται πάντα στα ανώτερα στρώματα του μίγματος.
Φασματοσκοπικές ιδιότητες
Ουσιαστικά όλες οι οργανικές ενώσεις περιέχουν δεσμούς άνθρακα-άνθρακα και άνθρακα-υδρογόνου, και έτσι παρουσιάζουν κάποια από τα χαρακτηριστικά των αλκανίων στο φάσμα τους. Αντίθετα, τα αλκάνια χαρακτηρίζονται από την απουσία άλλων χαρακτηριστικών ομάδων εκτός από τις παραπάνω με αποτέλεσμα την απουσία στο φάσμα των αντίστοιχων χαρακτηριστικών απορροφήσεων. Γι' αυτό το λόγο τα αλκάνια είναι πολύ καλοί διαλύτες άλλων ουσιών ιδιαίτερα για την μελέτη των τελευταίων με φασματοσκοπία υπεριώδους-ορατού.
Στα φάσματα υπερύθρου (IR) η δόνηση τάσεως του δεσμού άνθρακα-υδρογόνου εμφανίζεται ισχυρή μεταξύ 2850 και 2950 cm-1, ενώ η αντίστοιχη του δεσμού άνθρακα-άνθρακα εμφανίζεται μεταξύ 700 και 1300 cm-1. Η δόνηση κάμψεως του δεσμού άνθρακα-υδρογόνου εξαρτάται από το είδος της ομάδας. Έτσι, στις μεθυλο-ομάδες εμφανίζεται στα 1430 – 1470 cm-1 και στα 1370 – 1380 cm-1, ενώ στις μεθυλενο-ομάδες στα 1445 – 1485 cm-1. Τέλος, αλκάνια με περισσότερα από τέσσερα άτομα άνθρακα παρουσιάζουν μία ασθενή απορρόφηση στα 720 – 750 cm-1.
Τα φάσματα πρωτονιακού πυρηνικού μαγνητικού συντονισμού (H-NMR) των αλκανίων είναι πολύ χαρακτηριστικά. Τα πρωτόνια των μέθυλο-ομάδων συντονίζονται περίπου στα 0,9 ppm, ενώ των μεθυλενο-ομάδων στα 1,25 ppm περίπου. Διάκριση μεταξύ γραμμικού και διακλαδισμένου αλκανίου μπορεί να γίνει με συγκριτική μελέτη της εμβαδομετρήσεως των κορυφών των μεθυλο- και μεθυλενο- ομάδων.
Η φασματοσκοπία μαζών αποτελεί μια πρώτης τάξεως μέθοδο για τη μελέτη της δομής είτε καθαρών είτε μιγμάτων αλκανίων. Αλκάνια με ευθεία αλυσίδα δίνουν φάσματα μαζών, χαρακτηριστικό των οποίων είναι η ύπαρξη ομάδων κορυφών που απέχουν κατά 14 μονάδες μάζας (-CH2-). Κάθε ομάδα αποτελείται από τρεις επιμέρους κορυφές που αντιστοιχούν στα CnH2n+1 (περισσότερο έντονη), CnH2n και CnH2n-1. Χαρακτηριστικό των διακλαδισμένων αλκανίων είναι το θραύσμα που αντιστοιχεί στο σημείο της διακλαδώσεως και εμφανίζεται με μεγαλύτερη ένταση.
Χημικές Ιδιότητες
Τα αλκάνια έχουν γενικά μικρή δραστικότητα, διότι οι δεσμοί άνθρακα – άνθρακα και άνθρακα – υδρογόνου είναι σχετικά σταθεροί και τα μόρια των αλκανίων δεν διαθέτουν άλλες χαρακτηριστικές ομάδες.
Παρόλα αυτά, σήμερα ορισμένες αντιδράσεις των αλκανίων και κυκλοαλκανίων έχουν εξαιρετική σπουδαιότητα τόσο στη διύλιση του πετρελαίου όσο και γενικότερα στην οργανική χημική βιομηχανία και χρησιμοποιούνται περισσότερο από κάθε άλλη αντίδραση.
Αλογόνωση
Η δραστικότητα των αλογόνων ακολουθεί την εξής σειρά: φθόριο > χλώριο > βρώμιο > ιώδιο. Έτσι, η απευθείας φθορίωση των αλκανίων γίνεται συνήθως βίαια και συχνά με έκρηξη. Γι' αυτό το λόγο εφαρμόζονται ειδικές μέθοδοι για την παρασκευή φθοροπαραγώγων. Η αντίδραση με χλώριο είναι σχετικά γρήγορη, με βρώμιο αργή και απαιτεί σημαντική ποσότητα υπεριώδους ακτινοβολίας, ενώ με ιώδιο ουσιαστικά δεν γίνεται.
Τα άτομα υδρογόνου των αλκανίων μπορούν να αντικατασταθούν από χλώριο ή βρώμιο δια μέσου μια αλυσωτής αντιδράσεως ελευθέρων ριζών, ο μηχανισμός της οποίας μπορεί να συνοψισθεί ως εξής:
* Έναρξη. Ένα μόριο αλογόνου (χλωρίου) διασπάται σε δύο ελεύθερες ρίζες με τη βοήθεια υπεριώδους ακτινοβολίας ή θέρμανσης.
Cl2 → 2 Cl·
* Διάδοση. Η ελεύθερη ρίζα του χλωρίου αποσπά ένα άτομο υδρογόνου από το αλκάνιο (RH) και στη συνέχεια η ρίζα αντιδρά με χλώριο δίνοντας το προϊόν της αλογόνωσης.
RH + Cl· → R· + HCl
R· + Cl2 → RCl + Cl·
Η ρίζα του χλωρίου στη συνέχεια θα πάρει μέρος στο επόμενο βήμα της αντίδρασης διάδοσης και ούτω κάθε εξής οδηγώντας σε αλυσωτή αντίδραση.
* Τερματισμός. Η αντίδραση ολοκληρώνεται με τους παρακάτω τρεις τρόπους:
R· + R· → R–R
R· + Cl· → RCl
Cl· + Cl· → Cl2
[Επεξεργασία] Νίτρωση
Κατά την κατεργασία αλκανίων με νιτρικό οξύ μπορούν να αντικατασταθούν ένα ή περισσότερα άτομα υδρογόνου από την νιτρο-ομάδα (-ΝΟ2). Η όλη αντίδραση είναι γνωστή ως νίτρωση. Η νίτρωση γίνεται είτε σε αέρια φάση (καταλληλότερη για αλκάνια μικρού μοριακού βάρους), είτε σε υγρή φάση, κατά την οποία αλκάνια μεγάλου μοριακού βάρους θερμαίνονται σε θερμοκρασία 140°C με πυκνό κιτρικό οξύ υπό πίεση.
Κατά την νίτρωση αλκανίων παράγονται μίγματα νιτροπαραφινών, ο σχηματισμός των οποίων οφείλεται όχι μόνο σε αντικατάσταση ατόμων υδρογόνου από νιτρο-ομάδες, αλλά και σε αντίδραση της νιτρο-ομάδας με οποιαδήποτε αλκυλο-ομάδα που θα μπορούσε να δημιουργηθεί από τη σχάση της αλυσίδας του υδρογονάνθρακα.
Η νίτρωση σε αέρια φάση ακολουθεί τον μηχανισμό ελεύθερων ριζών. Σε αυτή την περίπτωση η ευκολία υποκαταστάσεως υδρογόνου από νιτρο-ομάδα ακολουθεί την παρακάτω σειρά εξαιτίας του ενδιάμεσου σχηματισμού σταθερότερων ριζών:
R3C-H > R2HC-H > RH2C-H
Οξείδωση
Όλα τα αλκάνια πάνω από μια ορισμένη θερμοκρασία, με περίσσεια οξυγόνου οξειδώνονται τόσο γρήγορα προς διοξείδιο του άνθρακα και νερό, ώστε να λέμε ότι καίγονται. Η γενική εξίσωση της πλήρους καύσης των αλκανίων έχει την παρακάτω μορφή:
2 CnH2n+2 + (3n+1) O2 → 2n CO2 + 2(n+1) H2O
Το ποσό της θερμότητας που ελευθερώνεται κατά την καύση του υδρογονάνθρακα (θερμότητα καύσεως) ισούται με την θερμότητα καύσεως της μεθυλενικής ομάδας (157 Kcal/mole) επί τον αριθμό n των μεθυλενικών ομάδων συν τη θερμότητα καύσεως των υπόλοιπων δύο ατόμων υδρογόνου (55 Kcal/mole).
Επίσης, τα αλκάνια σε σύγκριση με πολλές άλλες τάξεις οργανικών ενώσεων, είναι αρκετά ανθεκτικά στην επίδραση συνηθισμένων οξειδωτικών μέσων. Έτσι, στη συνηθισμένη θερμοκρασία, το υπερμαγγανικό ή το διχρωμικό κάλιο προσβάλουν αρκετά αργά τα αλκάνια. Παρόλα αυτά, αλκάνια με τριτοταγές άτομο άνθρακα (παράδειγμα ισοβουτάνιο) στη συνηθισμένη θερμοκρασία οξειδώνονται σχετικά εύκολα με υπερμαγγανικό κάλιο.
[Επεξεργασία] Χρήσεις
Τα αλκάνια αποτελούν βασική πηγή ενέργειας, ιδιαίτερα με τη μορφή ακάθαρτου και φωτιστικού πετρελαίου και του φυσικού αερίου. Χρησιμοποιούνται επίσης ως διαλυτικά μέσα, ως λιπαντικά έλαια και με τη μορφή των αλάτων σουλφοξέων με νάτριο στη βιομηχανία των απορρυπαντικών.
Κίνδυνοι για την υγεία
Το μεθάνιο καθώς και άλλα αλκάνια χαμηλού μοριακού βάρους μπορούν να δημιουργήσουν εκρηκτικά μίγματα με τον αέρα (1-8% CH4) ενώ το μεθάνιο θεωρείται ισχυρό αέριο του θερμοκηπίου. Τα ελαφρά υγρά αλκάνια είναι εξαιρετικά εύφλεκτα αλλά αυτός ο κίνδυνος μειώνεται με την αύξηση του μήκους της ανθρακικής αλυσίδας. Τα πεντάνιο, εξάνιο, επτάνιο και οκτάνιο έχουν επισημανθεί από την Ευρωπαϊκή Ένωση ως επικίνδυνα για το περιβάλλον και επιβλαβή.
Βιβλιογραφία
* Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
* Coates J., “Interpretation of Infrared Spectra, A Practical Approach”, Encyclopedia of Analytical Chemistry, R.A. Meyers (Ed.), pp. 10815-10837, John Wiley & Sons Ltd, Chichester (2000).
* Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
Από την Live-Pedia.gr
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License